|

ทฤษฎีการชนกันหรือทฤษกีการปะทะ
(Collision Theory) เป็นทฤษฎีสำหรับอธิบายการเกิดปฏิกิริยาเคมี
มีการชนกันด้วยทิศทางที่เหมาะสม และมีพลังงานมากพอ
จึงจะสมารถเกิดปฏิกิริยาเคมีได้ ส่วนพลังงานน้อยที่สุดที่โมเลกุลของสารตั้งต้นจำเป็นต้องมี
เพื่อใช้ในการเกิดปฏิกิริยาเคมี เรียกว่า
พลังงานก่อกัมมันต์ ( Activation Energy
) ตัวอย่างเช่น
ปฏิกิริยาระหว่างแก๊สไฮโดรเจนกับแก๊สไอโอดีนเกิดเป็นก๊าชไฮโดรเจนไอโอไดด์
ดังสมการ 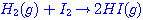 จะต้องมีพลังงานสูงพอ และเข้าชนกันในทิศทางที่เหมาะสม จะต้องมีพลังงานสูงพอ และเข้าชนกันในทิศทางที่เหมาะสม
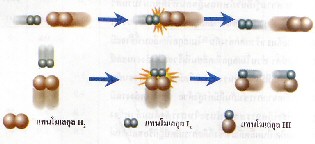
ภาพแสดงการจัดเรียงโมเลกุลของ
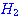 และ และ 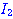 ขณะชนกัน ขณะชนกัน
การเข้าชนกันของโมเลกุล
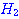 , ,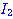 , , ก. ไม่เกิดปฏิกิริยา ข. เกิดปฏิกิริยา ก. ไม่เกิดปฏิกิริยา ข. เกิดปฏิกิริยา

|

